Τι είναι η μεσογειακή αναιμία;
Τι είναι η μεσογειακή αναιμία;
Ο όρος μεσογειακή αναιμία χρησιμοποιείται συχνά ως συνώνυμος του όρου θαλασσαιμία και με αυτόν περιγράφουμε μία ομάδα κληρονομικών νόσων, που χαρακτηρίζονται από ελαττωματική παραγωγή αιμοσφαιρίνης. Ο όρος «θαλασσαιμία» προέρχεται – προφανώς – από τη λέξη «θάλασσα», διότι η κλινική αυτή οντότητα για πρώτη φορά περιγράφηκε μεταξύ πληθυσμών, που ζουν πέριξ της Μεσογείου Θάλασσας. Εντούτοις, η συχνότητα της θαλασσαιμίας είναι υψηλή και σε περιοχές της Μέσης Ανατολής, της Αφρικής και της Ασίας (National Center for Biotechnology Information, 1998).
Γιατί παρουσιάζεται η θαλασσαιμία;
Η αιμοσφαιρίνη είναι η πρωτεΐνη του αίματος, που είναι «επιφορτισμένη» με τη μεταφορά του οξυγόνου από τους πνεύμονες στους ιστούς και εντοπίζεται εντός των κυττάρων του αίματος, που ονομάζονται ερυθρά αιμοσφαίρια. Η αιμοσφαιρίνη με τη σειρά της αποτελείται από δύο ζεύγη πρωτεϊνικών αλυσίδων (πιο «σωστός» είναι ο όρος «πολυπεπτιδικών αλυσίδων»): ένα ζεύγος αλυσίδων α και ένα ζεύγος αλυσίδων β. Κάθε αλυσίδα είναι συνδεδεμένη με ένα μόριο Αίμης καθώς και ένα άτομο Σιδήρου (βλ. εικόνα).
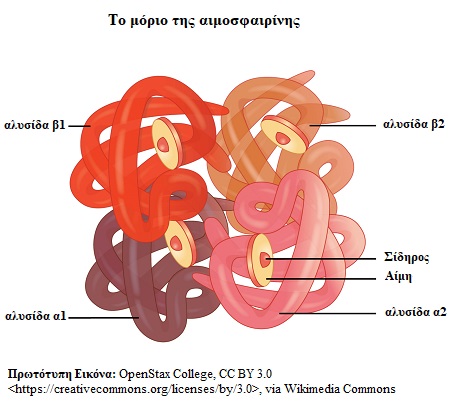
Ανάλογα με το αν το γονίδιο, που φέρει την παθολογική μετάλλαξη και κωδικοποιεί για την α ή τη β αλυσίδα της αιμοσφαιρίνης, οι θαλασσαιμίες διακρίνονται σε α και β θαλασσαιμίες. Στην Ελλάδα η συντριπτικά συνηθέστερη θαλασσαιμία, που απαντάται είναι η β θαλασσαιμία. Έχει υπολογιστεί, πως στην περιοχή της Ελλάδος, της Κύπρου και της Τουρκίας μάλιστα το ποσοστό των «φορέων» φθάνει κατά περιοχή και το 15% (Needs και συνεργάτες, 2023). Με αυτή τη μορφή θαλασσαιμίας θα ασχοληθούμε στο πόνημα αυτό.
Πώς επηρεάζεται η υγεία του ατόμου από τη Μεσογειακή αναιμία;
Στο σημείο αυτό θα πρέπει να γίνει διαχωρισμός μεταξύ:
• των ατόμων, που νοσούν από κάποια μορφή β θαλασσαιμίας
• των ατόμων, που είναι φορείς της β θαλασσαιμίας, έχουν δηλαδή το «στίγμα»
Πώς επηρεάζεται η γονιμότητα των ατόμων, που νοσούν;
Οι ασθενείς με την ενδιάμεση μορφή β θαλασσαιμίας, παρουσιάζουν τα πρώτα σημεία αναιμίας μετά τη συμπλήρωση 2 ετών και κατά κανόνα δεν χρειάζεται να υποβάλλονται σε τακτικές μεταγγίσεις αίματος. Εντούτοις, παρουσιάζουν δομικές διαταραχές σε διάφορα όργανα του σώματός τους (σπλήνας, ήπαρ, λεμφαδένες), αλλά και στα οστά (θώρακας και σπονδυλική στήλη), τα οποία συχνά προσβάλλονται από οστεοπόρωση. Επίσης τα άτομα αυτά συχνά εμφανίζουν χολολιθίαση (δημιουργία λίθων στη χοληδόχο κύστη) και έντονη προδιάθεση για την εκδήλωση θρομβώσεων (Origa & Comitini, 2019). Η πιθανότητα θρομβώσεων κατά τη διάρκεια της κύησης είναι και από τις βασικότερες επιπλοκές, που συνδέονται με την παθολογία αυτή (Petrakos και συνεργάτες, 2016).
Τα άτομα με μείζονα Μεσογειακή Αναιμία χρειάζονται μεταγγίσεις σε τακτικά χρονικά διαστήματα. Η διαδικασία της μετάγγισης όμως συνδέεται με υπερβολική αύξηση της ποσότητας σιδήρου, που εντοπίζεται στο σώμα. Ο σίδηρος επικάθεται σε διάφορα όργανα του σώματος, στα οποία και προκαλεί ιστική βλάβη. Το βασικότερο εκ των οργάνων, που βλάπτονται από το σίδηρο σε τέτοιες περιπτώσεις είναι η καρδιά. Για το λόγο αυτό χορηγούνται στα άτομα αυτά φαρμακευτικές ουσίες, που προκαλούν την απομάκρυνση του υπερβάλλοντος σιδήρου από το αίμα μέσω της ούρησης. Τέτοιου είδους ουσίες ονομάζονται χηλικοί παράγοντες (Origa & Comitini, 2019).
Η αναπαραγωγική διαδικασία τόσο στον άνδρα, όσο και στη γυναίκα εξαρτάται από τη λειτουργική ακεραιότητα του υποθαλάμου και της υπόφυσης (βλ. εικόνα).
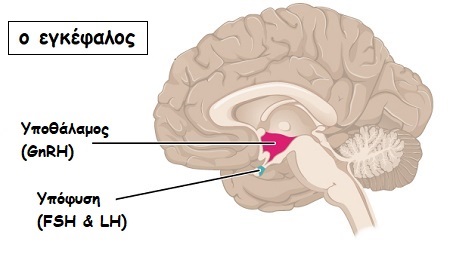
Πρόκειται για εξειδικευμένες περιοχές του εγκεφάλου, εκ των οποίων εκκρίνονται ορμόνες, που αλληλεπιδρούν με τις γονάδες (ωοθήκες των γυναικών, και όρχεις των ανδρών), οι οποίες αποτελούν αφενός την έδρα παραγωγής αναγκαίων για την αναπαραγωγική λειτουργία ορμονών, αφετέρου της παραγωγής ωρίμων γαμετών (δηλαδή των γεννητικών κύτταρων: ωάρια για της γυναίκες και σπερματοζωάρια για τους άνδρες). Ο υποθάλαμος, η υπόφυση και οι γονάδες αντιμετωπίζονται ως ενιαία λειτουργική οντότητα, όσον αφορά την αναπαραγωγική διαδικασία, η οποία ονομάζεται «άξονας υποθαλάμου – υπόφυσης – γονάδων».
Εκ των διαθεσίμων στοιχείων, φαίνεται, πως καίτοι τα τελευταία χρόνια έχει εξελιχθεί η θεραπεία των μεταγγιζόμενων ατόμων χάρη στη διαθεσιμότητα όλο και πιο εξελιγμένων χηλικών παραγόντων, το πρόβλημα της υψηλής συγκέντρωσης σιδήρου στο αίμα δεν έχει πλήρως επιλυθεί. Ο σίδηρος συγκεντρώνεται κατά κύριο λόγο στην υπόφυση παρεμποδίζοντας την έκκριση των ορμονών της. Συγκέντρωση σιδήρου έχουμε και στις ωοθήκες, αλλά και στους όρχεις, με αποτέλεσμα να παρεμποδίζεται και η εκεί παραγωγή ορμονών, αλλά και γαμετών (Petrakos και συνεργάτες, 2016; Origa & Comitini, 2019). Έτσι, έχει υπολογιστεί, πως ποσοστό, το οποίο κυμαίνεται μεταξύ του 51% και του 66% των ατόμων με μείζονα νόσο και με υψηλή ποσότητα σιδήρου στο αίμα τους παρουσιάζουν διαταραχές στην έναρξη της εφηβείας, σεξουαλικές διαταραχές, υπογονιμότητα και χαμηλό ύψος (De Sanctis, 2002; De Sanctis και συνεργάτες, 2013).
Όσον αφορά τη γονιμότητα της γυναίκας, έχει διατυπωθεί η άποψη, πως η μέτρηση των επιπέδων της ορμόνης AMH είναι ένας χρήσιμος δείκτης στην εκτίμησή της παρουσία μείζονος β Θαλασσαιμίας (Petrakos και συνεργάτες, 2016; Origa & Comitini, 2019). Θεωρείται δε, πως γυναίκες με ηλικία μικρότερη των 30 με 35 ετών έχουν συνήθως ικανοποιητική ωοθηκική λειτουργία (Singer και συνεργάτες, 2011). Εντούτοις, τα επίπεδα AMH σε γυναίκες με τη συγκεκριμένη νόσο είναι κατά μέσο όρο χαμηλότερα από τα αντίστοιχα, που μετρώνται σε γυναίκες με την ίδια ηλικία, που δεν νοσούν (Chang και συνεργάτες, 2011). Εν πάσει περιπτώσει δεν αποκλείεται κάποιες γυναίκες με μείζονα νόσο να ανταποκριθούν σε πρωτόκολλα εξωσωματικής γονιμοποίησης (Petrakos και συνεργάτες, 2016; Origa & Comitini, 2019). Έχει μάλιστα διατυπωθεί η υπόθεση, πως παρ’ όλο, που οι γυναίκες με μείζονα β Θαλασσαιμία έχουν κατά μέσο όρο χαμηλότερη AMH, η ποιότητα των ωαρίων, που συλλέγονται στα πλαίσια της διαδικασίας της εξωσωματικής κατ’ ουσίαν δεν επηρεάζεται ουσιωδώς (Mensi και συνεργάτες, 2019).
Η σπερματογένεση είναι μία διαδικασία, που επηρεάζεται αρνητικά από τη μείζονα β Θαλασσαιμία (De Sanctis και συνεργάτες, 2018), αλλά αρνητικά φαίνεται, ότι επηρεάζεται και το γενετικό υλικό των σπερματοζωαρίων (Elsedfy και συνεργάτες, 2018).
Δείτε ΕΔΩ πότε είναι οι γόνιμες ημέρες σας!
Δρ ΜΕΝΕΛΑΟΣ ΚΩΝ. ΛΥΓΝΟΣ, MSc, PhD
ΜΑΙΕΥΤΗΡ ΧΕΙΡΟΥΡΓΟΣ ΓΥΝΑΙΚΟΛΟΓΟΣ
Master of Science University College London
Διδάκτωρ Μαιευτικής Γυναικολογίας
Ενδεικτική βιβλιογραφία
Chang HH, Chen MJ, Lu MY, Chern JP, Lu CY, Yang YL, Jou ST, Lin DT, Yang YS, Lin KH. Iron overload is associated with low anti-müllerian hormone in women with transfusion-dependent β-thalassaemia. BJOG. 2011 Jun;118(7):825-31. doi: 10.1111/j.1471-0528.2011.02927.x. Epub 2011 Mar 15. PMID: 21401854.
De Sanctis V, Soliman AT, Elsedfy H, Skordis N, Kattamis C, Angastiniotis M, Karimi M, Yassin MA, El Awwa A, Stoeva I, Raiola G, Galati MC, Bedair EM, Fiscina B, El Kholy M. Growth and endocrine disorders in thalassemia: The international network on endocrine complications in thalassemia (I-CET) position statement and guidelines. Indian J Endocrinol Metab. 2013 Jan;17(1):8-18. doi: 10.4103/2230-8210.107808. PMID: 23776848; PMCID: PMC3659911.
De Sanctis V, Soliman AT, Yassin MA, Di Maio S, Daar S, Elsedfy H, Soliman N, Kattamis C. Hypogonadism in male thalassemia major patients: pathophysiology, diagnosis and treatment. Acta Biomed. 2018 Feb 16;89(2-S):6-15. doi: 10.23750/abm.v89i2-S.7082. PMID: 29451224; PMCID: PMC6179033.
De Sanctis V. Growth and puberty and its management in thalassaemia. Horm Res. 2002;58 Suppl 1:72-9. doi: 10.1159/000064766. PMID: 12373018.
Elsedfy H, De Sanctis V, Ahmed AY, Mohamed NR, Arafa M, Elalfy MS. A pilot study on sperm DNA damage in β-thalassemia major: is there a role for antioxidants? Acta Biomed. 2018 Mar 27;89(1):47-54. doi: 10.23750/abm.v89i1.6836. PMID: 29633742; PMCID: PMC6357624.
Mensi L, Borroni R, Reschini M, Cassinerio E, Vegetti W, Baldini M, Cappellini MD, Somigliana E. Oocyte quality in women with thalassaemia major: insights from IVF cycles. Eur J Obstet Gynecol Reprod Biol X. 2019 May 13;3:100048. doi: 10.1016/j.eurox.2019.100048. PMID: 31404374; PMCID: PMC6687400.
National Center for Biotechnology Information (US). Genes and Disease [Internet]. Bethesda (MD): National Center for Biotechnology Information (US); 1998-. Thalassemia. Available from: https://www.ncbi.nlm.nih.gov/books/NBK22200/
Needs T, Gonzalez-Mosquera LF, Lynch DT. Beta Thalassemia. [Updated 2023 May 1]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK531481/
Origa R, Comitini F. Pregnancy in Thalassemia. Mediterr J Hematol Infect Dis. 2019 Mar 1;11(1):e2019019. doi: 10.4084/MJHID.2019.019. PMID: 30858957; PMCID: PMC6402552.
Petrakos G, Andriopoulos P, Tsironi M. Pregnancy in women with thalassemia: challenges and solutions. Int J Womens Health. 2016 Sep 8;8:441-51. doi: 10.2147/IJWH.S89308. PMID: 27660493; PMCID: PMC5019437.
Singer ST, Vichinsky EP, Gildengorin G, van Disseldorp J, Rosen M, Cedars MI. Reproductive capacity in iron overloaded women with thalassemia major. Blood. 2011 Sep 8;118(10):2878-81. doi: 10.1182/blood-2011-06-360271. Epub 2011 Jul 14. PMID: 21757620; PMCID: PMC3172803.